RMP(医薬品リスク管理計画書)とは?記載事項や活用について解説 #064

2024.02.22
2024.05.10
医療従事者や医薬品に関わる業務に携わる方であれば、RMPという言葉を耳にしたことがあるかもしれません。しかし一方で、RMPがどのようなものかよく分からないという方もいるでしょう。
本記事では、RMP(医薬品リスク管理計画書)について解説していきます。
目次
RMPとは
RMPは医薬品リスク管理計画書といい、製薬会社が厚生労働省に提出する資料を指します。開発から市販した後までの医薬品のリスク管理を一貫して一つの文書にまとめ、医薬品リスクを低減させるために調査や試験などを定期的に、あるいは進捗に合わせて実施するようにするためのものです。RMPが作成されることによって、医療機関は安全性リスクを把握しながら、患者さんにとって適切な医薬品を選択できます。
RMPの目的
RMPは、開発段階から製造販売後までの期間で、医薬品の効能と副作用をはじめとしたリスクを評価することに用いられます。RMPによって蓄積・収集された情報に基づき、必要な安全対策を講じることで、副作用の早期発見につながります。
また、小児や高齢者の使用など、特定の条件下で懸念されるリスクについても知ることができるなど、不足情報の収集の点からもRMPは活用できるでしょう。
3つの基本要素
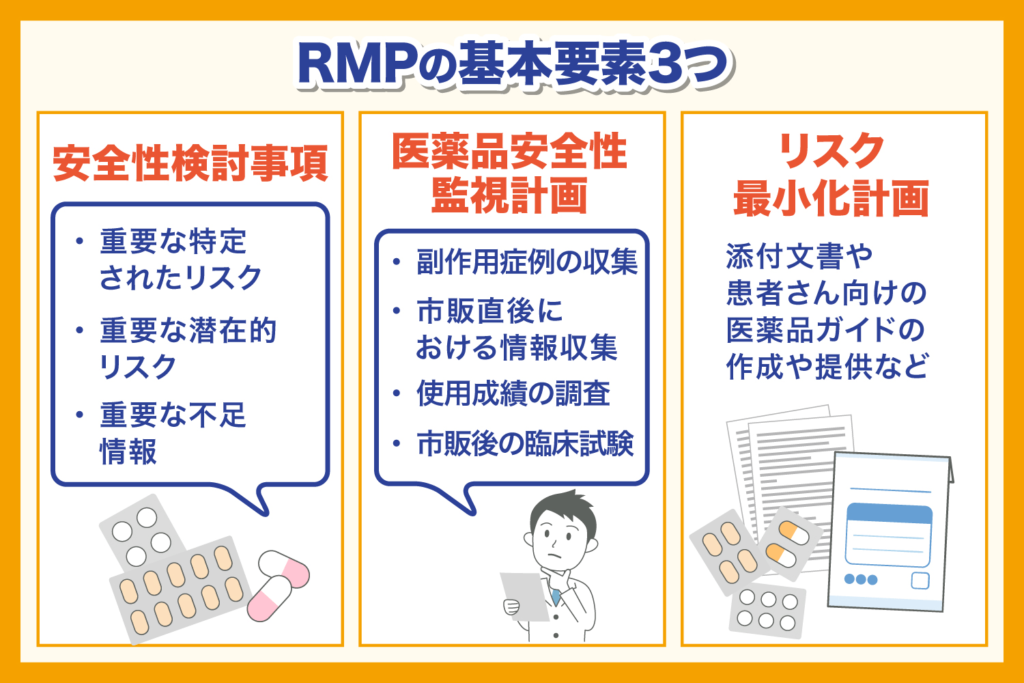
RMPは以下の3つの要素から構成される文書です。
- 安全性検討事項
- 医薬品安全性監視計画
- リスク最小化計画
以下では、それぞれについて解説します。
安全性検討事項
RMPに記載されている3つのリスクは、まとめて安全性検討事項と呼びます。
1つ目は、対象となる医薬品によって有害な事象があることが十分な根拠によって示されている、重要な特定されたリスク。2つ目は、有害な事象があり、対象となる医薬品との関連性も疑われるものの、臨床データなどからは十分な根拠が確認できない、重要な潜在的リスク。3つ目が、RMP作成時点では対象となる医薬品の安全性を示す上で、不足している情報のうち重要とされる、重要な不足情報です。
医薬品安全性監視計画
医薬品安全性監視計画は、情報収集としての性質を持ちます。情報収集のための活動は、通常の活動と追加の活動に分けられます。
通常の活動は、副作用症例の収集です。追加の活動は、市販直後における情報収集、使用成績の調査、市販後の臨床試験などが挙げられます。
リスク最小化計画
リスク最小化計画は、情報提供としての性質を持ちます。こちらも医薬品安全性監視計画と同じく、活動は2種類に分けられます。
通常の活動は、添付文書や患者さん向けの医薬品ガイドの作成や提供などです。追加の活動は、市販直後の調査として情報提供をしたり、該当の医薬品を適正に使用するための資料を配布したり、使用条件を設定したりするなどの活動です。
また、追加のリスク最小化計画にて作成された資材には、医薬品リスク管理計画(RMP)マークが付けられています。
添付文書とRMPの違い
RMPと似たものに添付文書がありますが、RMPではより広い情報が得られるといえます。以下では添付文書とRMPの違いについて解説します。
添付文書とRMPの違いについて解説リスク最小化計画
添付文書には、該当する医薬品の治験時や市販後に確認されている副作用が記載されています。その副作用の種類としては、重大な副作用だけではなく、その他の副作用も含まれます。
RMPで分かること
RMPでは添付文書と同様、治験時や市販後に確認されている副作用のほか、重要な特定されたリスクや、関連は疑わしいレベルではあるものの、確認が十分でない副作用など、重要な潜在的リスクも記載されています。また、高齢者や小児など症例数が不足しているため、副作用が起こる条件が判明していないリスク情報も知ることができます。
その他、リスクの種類だけでなくリスクとした理由が記載されている点が、添付文書との違いです。
RMPの入手方法
現在作成されているRMPは、PMDA(独立行政法人 医薬品医療機器総合機構)のホームページから閲覧が可能です。RMP提出品目一覧から閲覧したい医薬品を探しましょう。
また、医療用医薬品のバナーから閲覧したい医薬品名を検索し、表示された検索結果の一般名を選択することでも、個別の医薬品のページからRMPの閲覧が可能です。なお、こちらのページでは医療従事者向け、患者向けのRMP資材の閲覧もできます。
RMPのライフサイクル
新たに医薬品を承認申請するときや、医薬品の製造販売後の安全性への懸念が判明したときに、RMPは作成されます。RMPは、ある特定の医薬品の副作用に関する報告を蓄積していくことで、副作用の早期発見や不足情報の収集に役立ちます。そのため、RMPは適宜更新されるものであり、情報を蓄積させていくためのツールとしての役割を持つでしょう。
また、RMPが終了したとしても、医療従事者は医薬品リスクの最小化に務めるとともに、新たな安全性への懸念が生じた際には、再審査により再度RMPを作成することもあります。このように、RMPは一度で終了する限定的なものではなく、必要に応じて何度でも作成されます。
RMPの活用はリスクの最小化につながる
RMPは、新薬を承認申請する際や、副作用の潜在的なリスクが懸念された際に作成されます。
確定されたリスクを知ることができる添付文書とは別に、RMPはリスクとする理由や情報不足により断定されていないリスクについても知ることができるため、医薬品リスクの最小化につながります。
医薬品のベネフィットとリスクをより深く把握し、リスクの最小化を図るためにもRMPへの理解を深めてみてはいかがでしょうか。





