
【プログラム医療機器とは】保険適用基準、クラス分類、承認フロー、アプリ事例などを解説#031他EBM関連TOPIXコラム
2023.01.27
2025.10.20
近年、日本ではプログラム医療機器と呼ばれる新たなジャンルの医療機器が次々と薬事承認されています。
睡眠や運動中のモニターができる時計など、私たちの身近にも増えてきており人気を博しています。医療従事者にも一般人にも需要が高まっており、注目されています。
それに伴い目立っているのが、スタートアップ企業から大手企業まで、開発に意欲的な企業の増加です。
本記事では、プログラム医療機器の概要から海外の最新情報までご紹介し、保険適用基準、クラス分類、承認フロー、アプリ事例などを解説します。
目次
プログラム医療機器とは
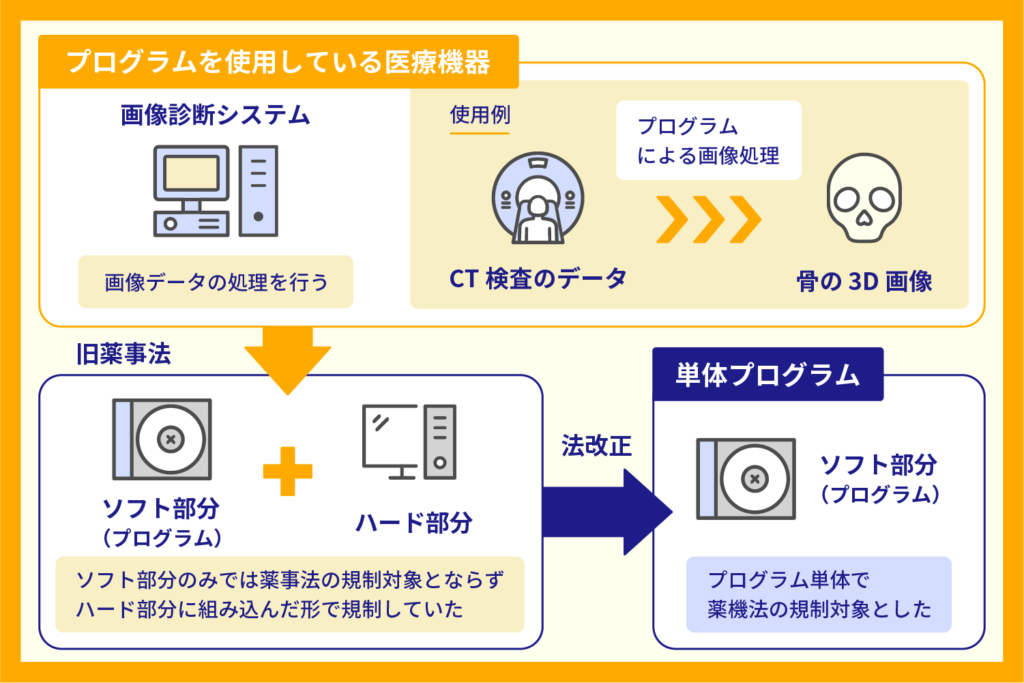
プログラム医療機器とは、医療機器の要素を持つプログラム(ソフトウェア機能)の搭載された記録媒体です。
医療機器は「疾病の診断・治療・予防などを目的に治療方針に寄与する」という性質を持ちます。
大きく分けてプログラム医療機器には、
- 疾病の診断に用いるもの
- 疾病の治療に用いるもの
の2つがあります。
例を挙げると、診断に用いるものとしては、画像を大量に学習したAIを活用し画像診断を支援するシステムがあります。
治療に用いるものとしては、医師が処方し、患者がスマートフォンにインストールして使用する治療用アプリなどがあり、次々と開発されています。
プログラム医療機器の承認を加速させる近年の動き
厚生労働省は、日本国内のプログラム医療機器の迅速な承認を進めています。
プログラム医療機器が世界中で次々に開発される中で、日本では承認に時間がかかるため開発が遅れているからです。
需要の高まりと世界的な開発のスピードに、国内の承認や実用化が追いついていない状況が指摘されています。
これを受けて、厚生労働省はプログラム医療機器の特性を踏まえて、効率的な規制を目的とした様々な取り組みを実施しました。近年の動きの要点は以下の通りです。
2014(平成26)年:薬事法改正。医療機器規制に関する章が医薬品から独立
単体のプログラムが医療機器の範囲に含まれることが明確化し、プログラム医療機器が規制の対象となりました。
2020(令和2)年:IDATEN(Improvement Design within Approval for Timely Evaluation and Notice)が法制化
本制度は、プログラム医療機器の特性に対応すべく導入されました。その特性とは、プログラム医療機器は通常の医療機器よりも市販後の改良が頻繁に行われるという点です。
具体的には、
- アプリのアップデート
- 市販後にその機器によって得たデータを用いた改良
などが発生するので、IDATENはそれに対応した制度と言えます。
これにより、AIを活用したプログラム医療機器の市販後の学習による変更が迅速に承認されるようになりました。
IDATENの他、価値のある新たな技術の審査を迅速に進める戦略の一つとして、「先駆的医療機器」に指定された機器が優先的に審査を受けられる制度が発足しました。
先駆的医療機器は、メーカーからPMDA(独立行政法人 医薬品医療機器総合機構)に相談・申請して認定を受けます。指定されるには、以下の要件を満たす必要があります。
- 治療法または診断法の画期性
- 対象疾患の重篤性
- 対象疾患に係る極めて高い有効性または安全性
- 世界に先駆けて日本で早期開発及び承認申請する意思並びに体制
2020(令和2)年:プログラム医療機器の実用化を促進する目的でプログラム医療機器実用化促進パッケージ戦略(DASH for SaMD)が法制化
本制度の内容の一つは、革新的なプログラム医療機器を迅速に審査するため、開発の段階で新しい技術を審査機関が把握することです。
また、開発から保険までの相談先を一元化することも盛り込まれています。
プログラム医療機器の開発には、多くのスタートアップ企業が関わっています。薬事開発に不慣れな企業が多いことから、相談先を統一して参入の障壁を取り除こうとしています。
2020(令和2)年:国内初治療用アプリが薬事承認
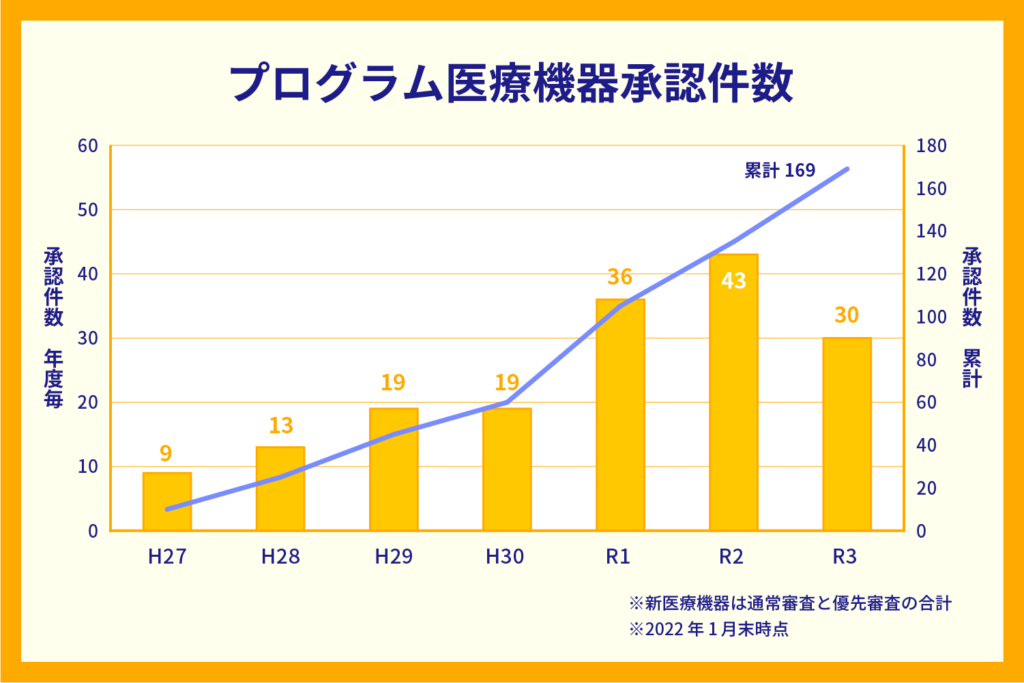
プログラム医療機器の承認件数推移
実際にプログラム医療機器の承認件数は増加傾向にあり、PMDAによると承認累計件数は2022年1月時点で169件です。
プログラム医療機器がもたらすインパクト
プログラム医療機器は一般の医療機器と異なる特徴を持つため、以下の4つの効果をもたらすと考えられます。
①疾病への早期介入
- 病気の早期または予防段階で、異変を検知したり、行動変容や受診を促したりすることによる重症化予防
- 重症化を防ぐことによる医療費の削減
②診断精度、治療精度向上
- 大量のデータを学習したプログラム医療機器による診断性能の向上
- 専門医と非専門医の能力差の補助
- バイタルデータ、手術画像によるリスク予測、術前シミュレーションを用いた手術の安全性向上
- 遠隔モニタリングによる術後フォロー
③臨床業務の効率化
- プログラム医療機器を用いた管理による受診頻度縮小
- 説明業務のプログラム医療機器への移行
④教育、臨床研究
- シミュレーションによる詳細なデータを使った教育、臨床研究
一方で、個人情報の適正使用や、AIの妥当性の担保、プログラムであるが故のサイバー攻撃へのリスクなど懸念される事項もあります。
安全性を確保したうえでの開発、承認が求められています。
承認されたプログラム医療機器の例
実際に日本で承認されたプログラム医療機器の例を紹介します。既にさまざまなプログラム医療機器が、私たちの健康から高度な医療までに貢献しています。
①AIを活用した画像支援システム(CAD: Computer-Aided Diagnosis)
内視鏡などの画像を大量に学習したAIが、病変の重症度や悪性度の判別を支援するシステムです。
国内で承認されたプログラム医療機器の中でも承認件数が多く、AIを活用したCADは十数品目承認されています。
医師の見落としを指摘したり、診断精度を向上したりするシステムとして貢献しています。
②治療用アプリ
生活習慣病や禁煙、精神神経系の疾患を対象とし、治療を目的とするスマートフォン用アプリが数件承認されています。
病院受診中だけでなく、日常生活における意識や行動、管理が重要となる疾患に適切な介入ができます。
アプリを処方された患者は、治療経過・日々の体調などをアプリに記入します。
その結果、アプリ内のアルゴリズムではじき出された行動変容、治療に関するガイダンスが提供されるのです。
医療者側でもアプリの使用状況や数値の推移を確認することができます。受診と受診の間に治療効果をもたらす画期的なシステムです。
③家庭用診断プログラム
身につける機器(ウェアラブルデバイス)により、抽出したデータをもとに心電図を構築し、波形の異常や不整脈を検知するシステムです。
病気になるリスクを早期に察知するのに役立つと考えられます。
④難病患者の治療薬スケジュールシミュレーション
難病患者の採血データと症状をもとに、各患者に対して治療薬の薬物動態をシミュレーションします。
治療薬の投与間隔と投与量を決定する際の情報提供を目的としています。
プログラム医療機器の海外事情
海外ではさらに速いスピードでプログラム医療機器が次々と生まれ、市場に流通しています。この章では、プログラム医療機器の海外事情を日本と比較しながら解説します。
プログラム医療機器の中でも、治療介入を提供するものをDTx(Digital therapeutics)と呼びます。
世界初のDtxは、2010年にアメリカで薬事承認を受けた糖尿病患者の治療アプリです。
一方で日本で最初にDTxが薬事承認を受けたのは2020年と、単純に比較すると10年程度の遅れがあったと考えることができます。
また、2020年の時点で、AIや機械学習を使ったプログラム医療機器の承認数は日米間で5倍の差があると指摘されています。
他国では、薬事承認を加速させて治療用アプリ開発への参入障壁を下げるための制度が整えられています。
例えば、ドイツやアメリカでは、臨床的な効果データが完全に蓄積する前に、セキュリティと安全性に重点を置いた要件を満たせば仮の保険適用の承認を受けることができ、患者に処方できます。
一年間、仮承認の期間に臨床効果データを蓄積することができれば保険適用の再申請が認められています。これで認められれば本登録となります。
日本でも開発促進のため制度の見直しが続いており、他国の例を参考にして障壁をさらに低くする可能性もあります。
このような開発促進の結果、アメリカでは予防、治療のアフターケア、医師業務支援などさまざまな分野でプログラム医療機器が実用化されており、専門性も多岐にわたっています。
ASEANなどアジアの国でも、日常的な健康管理や病気の早期発見に役立つプログラム医療機器のニーズが高く、市場が活発になっています。
このようにプログラム医療機器の市場は世界中に広がっているのです。
プログラム医療機器のデメリット
プログラム医療機器は機能が多岐にわたっていますが、以下のような共通のデメリットもあります。
- AIの判断はブラックボックスで妥当かどうか判断するのが難しい場合がある
- 個人情報漏洩の危険性があり、適正使用が遵守される必要がある
- 個人情報の取扱規制が機関ごとに完全に一致していない
- 副作用が少なく気軽に使用できるため「とりあえず」利用される傾向となり、不適正に使用される可能性がある
- サイバー攻撃を受ける可能性がある
開発から承認の流れと課題
ここでは、プログラム医療機器の開発から承認までの手順と、それに関する課題について解説します。
プログラム医療機器の開発を検討する際に、これらを事前に把握することでビジネス戦略が立てやすくなります。
開発から承認の流れ
プログラム医療機器の承認には、いくつかの規制をクリアする必要があります。
医療機器を製造販売しようとする際には、
- 販売する企業に対する規制「業態許可」
- 取り扱う商品に対する規制「製造販売承認等」
- 製造所に対する規制「QMS症例」
の手続きが必要です。
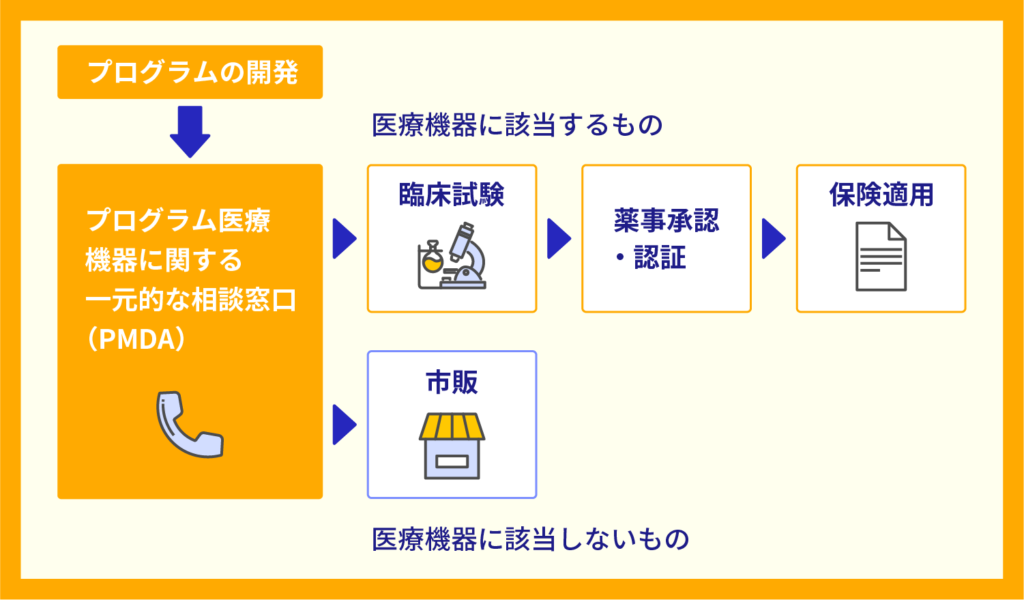
このうち、取り扱う商品について以下のようなフローで手続きします。
治療・診断プログラムの開発(メーカー)の場合
- 医療機器に該当するか否かの判断(厚労省やPMDA)
- 医療機器に該当する場合、臨床試験などを実施(メーカー)
- 薬事承認・認証(薬事・食品衛生審議会)
- 保険適用(中央社会保険審議会)
詳しくは、厚生労働省から承認申請ガイダンスが公表されていますのでご参照ください。
開発から承認までの課題
プログラム医療機器の開発から承認まで、以下のようなさまざまな課題があります。
開発段階
- 医療機器に該当するかどうかの判断が難しい
- 保険償還以外でマネタイズしにくく、医療機器に該当するかどうかでビジネスモデルも大きく異なるため、開発段階で戦略が立てにくい
- 個人情報の取り扱いが煩雑、良質で十分な医療データを集めるのが困難
- 臨床試験実施のハードルが高い
薬事承認段階
- 承認審査に時間がかかり、見通しが立ちにくい
- 評価の基準が不明瞭
上市段階
- 現行の保険医療制度でプログラム医療機器のメリットが評価されにくい
これらの課題を見ると、開発するシステムの目的やどのように医療介入をするのかを早期に明らかにし、承認までの見通しを立てることが必要だとわかります。
ビジネスモデルを構築するためにも、PMDAに設置された一元的な相談窓口である医療機器総合相談を早期から活用しましょう。
また、開発・承認にあたり、医療関係特有の品質保証の確保が重要です。
新規参入企業にとっては医療データ、臨床試験など不慣れな行程を乗り越える必要があります。開発段階から良質な医療データを安全に使用することも肝要です。
薬事承認の評価基準
薬事承認の評価基準に関してはPMDAから情報公開されているため、積極的に情報収集する必要があります。
システムの評価基準として、焦点とされる項目には以下のような点が挙げられます。
- 治療や診断にどの程度寄与できるのか、精度はどのくらいか
- 対象となる人はどんな人か(健康な人、軽症な人、重症な人)
- 患者にどの程度有用性を与えることができるのか
- 医療者側のメリットは何か
- 正常に働かなかった時の危険性がどの程度あるか
プログラム医療機器に関する薬事規制
プログラム医療機器は医療機器の一種です。したがって医療機器の基準でクラス分類され、その分類に応じて薬事規制がかかります。
医療機器のクラス分類は「作動不良時に患者にどの程度危害を与えるか」で分けられます。分類されたカテゴリにより、承認の難易度やハードルが異なります。
診断・治療・予防を目的とする医療機器の中で、作動不良時に患者に危害を与えないものが一般機器です。
プログラム医療機器に関して、「作動不良時に患者に危害を与えない、一般機器に相当するもの」は、厳密にはプログラム医療機器から除外されます。薬事承認も受けなくてよいと定められています。
以下、医療機器のクラス分類です。
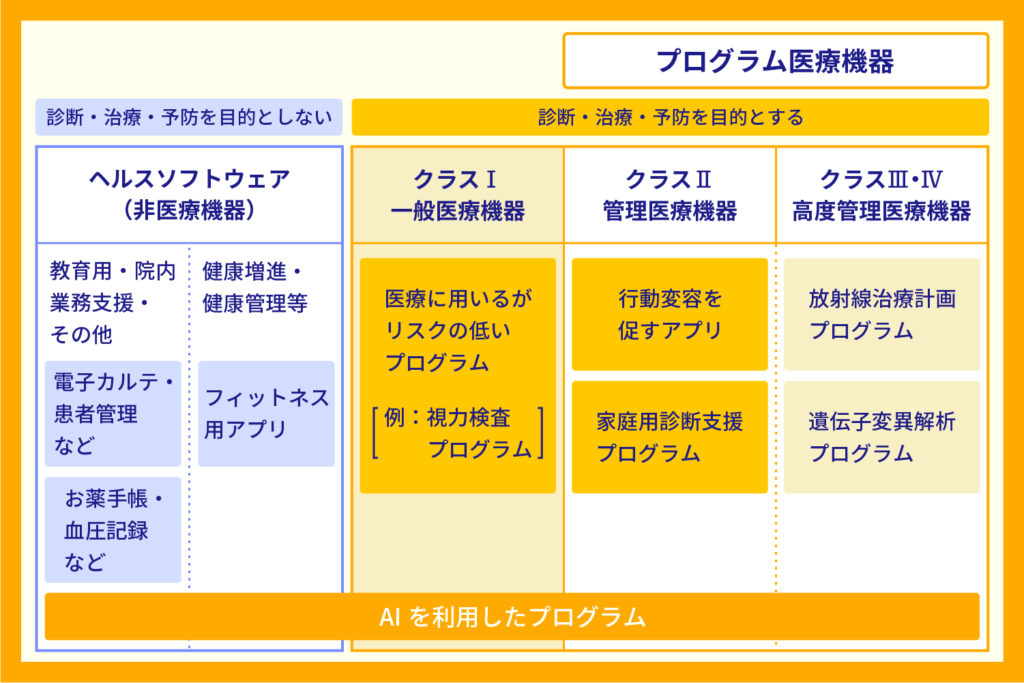
似たような機能を持った商品でも「どんな人を対象に、どの程度の治療・診断介入をすると認定されるか」によって分類が変わることがしばしば起こります。
医療機器に分類されるかどうかで保険収載を目指すかどうかや広告の規制が異なり、ビジネス戦略が大きく変わるので開発者が知識を持つことが必要です。
また、プログラム医療機器の診療報酬に関する評価体系はいまだ議論されている最中で変革期にあります。
プログラム医療機器の保険収載の意義
そもそも保険収載されるということは、健康保険からの給付の対象になるということです。
健康保険からの給付の対象にならなければ、システム導入にあたるコストは病院が持つことになり、販売する病院が著しく制限されてしまいます。必然的に、保険収載できるかどうかはビジネスにおいて重要なのです。
既存の保険適用の基準の問題点は、プログラム医療機器の特長が十分評価されない事です。
例えば「治療の効率性をあげる」「行動変容を促す」というメリットは今までになく新しい利点であるため、まだ評価基準に十分に反映されていません。
2022年度にも基準が変更されました。しかし、依然としてプログラム医療機器における保険収載の難易度は非常に高い状況です。
保険償還により企業や病院側にメリットを与えることがプログラム医療機器の普及につながるので、基準の整備が待たれます。
開発に際しデータ活用の際には当社お問い合わせください
プログラム医療機器の開発に際して、医療データ(画像、診療データなど)を分析したり、AIに学習させたりして活用する必要があります。さらに、質が良く安全なデータが不可欠です。
そして、個人情報の匿名化やデータ収集の同意など、確実な取り扱いが必要です。また、AIの精度はデータの質に依存するため、データ品質を担保することも重要です。
当社では、病院データの登録患者及び病院総数が4,232万人(2022年12月末現在)・474施設(同)と日本最大規模の診療データベースを保有しています。
データ活用の際には、当社まで気軽にお問い合わせください。
もどる

© Medical Data Vision Co., Ltd. All Rights Reserved.




